18052091425(微信同号)
应用简介
质粒多为一些双链、环状的DNA分子,是独立于细菌染色体之外进行复制和遗传的辅助性遗传单位。质粒是进行分子生物学实验操作,进行遗传工程改良物种等工作时最主要的DNA载体。
技术原理
质粒DNA提取方法有3种:碱裂解法、煮沸法和去污剂(如Triton和SDS)裂解法。前两种方法比较剧烈,适用于较小的质粒(<15kb)。去污剂裂解法则比较温和,一般用于分离大质粒(>15kb)。碱裂解法是一种应用为广泛的制备质粒DNA的方法,其原理为:染色体DNA比质粒DNA分子大得多,且染色体DNA为线状分子,而质粒DNA为共价闭合环状分子;当用碱处理DNA溶液时,线状染色体DNA容易发生变性,共价闭环的质粒DNA在回到中性时即恢复其天然构象;变性染色体DNA的片段与变性蛋白质和细胞碎片结合形成沉淀,而复性的超螺旋质粒DNA分子则以溶解状态存在液相中,离心去除沉淀后,就可从上清中回收质粒DNA。目前,市面上质粒提取试剂盒大多数都是采取上述的碱裂解方法,不同之处在于纯化方式。目前比较常用的纯化系统是硅基质吸附材料,其原理为在高盐环境下质粒DNA能够结合到硅基质上,然后用低盐缓冲液或水将质粒DNA从硅基质上洗脱下来。得到的质粒可以用于酶切、PCR、测序、细菌转化、转染等分子生物学实验。
实验方法
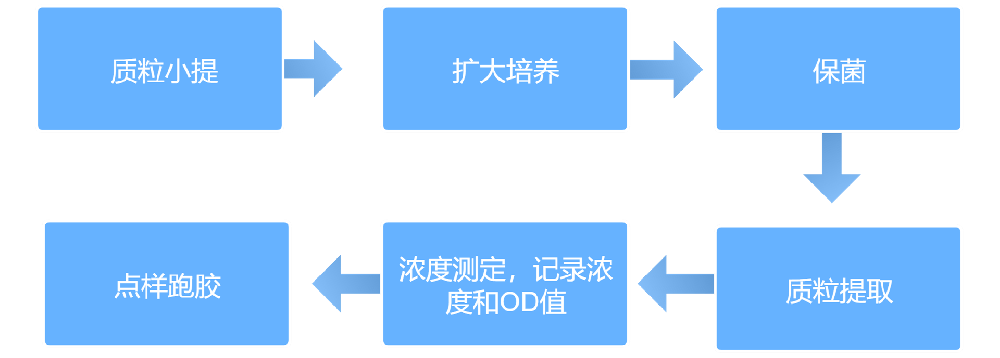
技术总结
1、时间控制问题
裂解时间太长,加入溶液P2后裂解时间不应超过5分钟;吸附时间不够;溶解时间不够都会导致质粒DNA提取实验失败。
2、质粒拷贝数低
由于使用低拷贝数载体引起的质粒DNA提取量低,可更换具体相同功能的高拷贝数载体。
3、溶液使用不当
溶液P2、P3在温度较低时可能出现浑浊,应置于37℃保温片刻直至溶解为清亮的溶液,才能使用。
4、吸附柱过载
不同产品中吸附柱吸附能力不同,如果需要提取的质粒量很大,请分多次提取。若用富集培养基,例如TB或者×YT菌液体积必须减少;若质粒或宿主菌是非常高的拷贝数或生长率,则需调整LB培养液体积。
5、质粒未全部溶解
洗脱溶解质粒时,可适当加温或延长溶解时间。
6、乙醇残留
漂洗液洗涤后应离心尽量去除残留液体,树脂型试剂盒漂洗后应晾干树脂,再加入洗脱缓冲液。
7、洗脱液加入位置不正确
洗脱液应加在硅胶膜中心部位以确保洗脱液会完全覆盖硅胶膜的表面达到最大洗脱效率。
8、洗脱液不合适
DNA只在低盐溶液中才能被洗脱。洗脱效率取决于pH值。最大洗脱效率在pH7.0~8.5间。当用水洗脱时确保其pH值在此范围内,如果pH过低可能性导致洗脱量低。洗脱时将灭菌蒸馏水或洗脱缓冲液加暖至60℃后使用有利于提高洗脱效率。